clorurarea metanului
hidrocarburi saturate reacționează activ cu clor. alcani clorurați atomi de clor sau de cationi care sunt mai reactive decât clorul molecular. Disocierea atomilor de clor pe moleculă necesită cheltuieli de 242,8 kJ / mol energie. O astfel de disociere a clorului are loc ușor la temperatura ambiantă sub absorbție a luminii UV a moleculei care dă o energie / mol 293,0 kJ. Pentru disocierea termică a atomilor de clor în moleculă, o temperatură de aproximativ $ 300 de ^ \ Circ \ C $. Clorul molecula de disociere în ioni necesită cheltuieli de 1130.2 kJ / mol. Din datele de energie arată că hidrocarburile saturate mai ușor de clorureze lume.
clorinare alcanilor are loc cu eliberarea de 108,8 kJ / mol de căldură este mai puțin exotermă decât fluorurare. clorurarea fotochimică alcanilor se efectuează la lumină ambientală, deoarece reacția directă a luminii are loc cu explozie. Când clorurarea hidrogeni alcanilor sunt înlocuite treptat cu clor. Ca rezultat, format hidrocarburi saturate hloropohidni.
Deci, în cazul în care un amestec de metan și clor să se încălzească până la 200 $ ^ \ Circ \ C $, sau să lucreze pe ea cu lumina UV de o lungime de undă corespunzătoare, care curge reacție puternic exotermă:
Figura 1. clorurarea metanului
Rezolvarea controlului în toate subiectele. 10 ani de experiență! Preț de la 100 de ruble. Perioada de la 1 zi!
Scriem ieftin și tocmai la timp! Mai mult de 50 000 de profesioniști dovedit
Oferta speciala! Oferirea de 100 de ruble.
un prim ordin!
de la 200 ruble / 2 ore de la
de la 350 ruble / 2 ore de la
de la 50 ruble / 2 ore de la
Efectul termic al primei clorurarea etapă de metan în faza gazoasă la $ CH_3Cl $ și $ $ HCl poate fi calculat pe baza legii Hess.
Figura 2. clorurarea metanului
Efectul termic total de $ \ Delta \ underline ^ \ = Circ - $ de 25 kcal / mol. Aceste date arată că clorurarea metanului este un proces destul de probabil, deși efectul termic nu este în nici un fel legate de viteza de reacție, care este determinată de energia liberă de activare.clorurarea mecanism radical de metan
Clorurarea alcani prin încălzire, iradiere și în prezența inițiatorilor radicali are loc cu lanț radical mecanism $ SR $ (Semenov) și constă din trei etape principale:
nucleată lanț (inițiere)
Figura 3. clorurarea metanului
Figura 4. clorurarea metanului
un circuit deschis (recombinare)
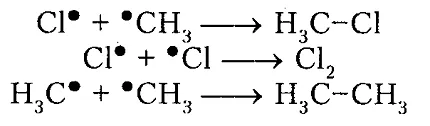
Figura 5. clorurarea metanului
Astfel, o molecula de clor $ Cl_2 $ sub acțiunea luminii ($ h \ $ Nu) sau sub încălzire primește un exces de energie devine excitat si se imparte in doi atomi, care sunt în mod inerent radical. atomul de clor radical în procesul de interacțiune sau coliziuni cu atom alte molecule clivează de hidrogen dintr-o moleculă de $ CH_4 $ metan pentru a forma metil $ radical ^ * CH_3 $. Aruncarea, la rândul său, clivează atomul de clor radical din molecula următoare $ Cl_2 $ etc. Astfel, unul format prin inițiații radicali multe repetiții cu lanț pas. Numărul de repetiții determină lungimea întregii reacția în lanț kinetic pentru clorurare poate ajunge la $ de 10 \ $ 000 sau mai mare.
Rezolvarea controlului în toate subiectele. 10 ani de experiență! Preț de la 100 de ruble. Perioada de la 1 zi!
Fig. 6 prezintă o diagramă energetică a clorurare metan.
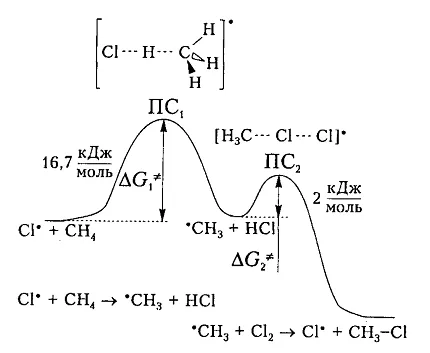
Figura 6. Diagrama schimbare liberă enthalpy atom interacțiune clor și o moleculă de metan
Legile clorurarea radical de metan
Pe baza considerațiilor teoretice clor si molecula de metan vor interacționa unul cu altul numai atunci când Entalpia lor liberă este egală cu magnitudinea barierei energetice (și energia de activare) 16,7 kJ / mol, care este întotdeauna puțin mai mare decât diferența (-6 kJ / mol) de energie de rupere vechi conexiune $ CH $ (kJ 425 / mol) și formarea unei noi obligațiuni - comunicare $ H-CI $ (-431 kJ / mol). Prin urmare, nu orice coliziune particule care determină interacțiunea lor, ci numai acelea care sunt suficiente pentru a depăși această barieră.
energie de activare suplimentară se datorează expunerii la căldură sau molecule. Moleculele excitate prezintă o viteză suficient de mare, din care energia cinetică este transformată în energie potențială în timpul coliziunii. In partea de sus a curbei în stare de tranziție $ $ PS_1 între reacționând componente ale complexului activat este format în care formarea $ C-H $ și clivaj obligațiuni vechi nou $ -CI $ au loc aproximativ simultan. Radicalul propulsorul format are o energie potențială suficientă și relativ ușor reacționat cu moleculă ulterioară $ Cl_2 $. Energia de activare a acestei etape este de numai 2 kJ / mol. Formarea compusului final $ CH_3Cl $ trece prin a doua etapă a complexului activat cu un $ PS_2 stare de tranziție. $
Rezolvarea controlului în toate subiectele. 10 ani de experiență! Preț de la 100 de ruble. Perioada de la 1 zi!
Clorurarea metanului și a altor alcani la temperaturi - proces plohoupravlyaemy care de obicei nu se oprește la formarea clorurii de metil $ CH_3C1 $ și pot să apară pe:
Figura 7. clorurarea metanului
Mecanismul de clorurare Ionic de metan
În prezența catalizatorilor (acizi Lewis $ A1C1_3 $, $ SbF_5 $), care contribuie la mecanismul de reacție ionic, procesul de clorurare într-un mediu de acid are un caracter electrofil ($ $ Se). Chimia interacțiunii elektronoaktseptornogo clorurii de aluminiu cu molecula de clor este polarizare substanțial nepolar comunicare $ C-C $, care provoacă sale de disociere pentru a forma agentul electrofil. Fără astfel de catalizatori de reacție de clorurare cu greu se produce deoarece în mod ionic scindarea heterolitice a moleculei într-un cation și anion clor necesită energie considerabilă (1130 kJ / mol).
Clorurarea hidrocarburilor saturate în prezența catalizatorilor, lanț ionic are loc mecanism elektrofilnym ($ Se $):
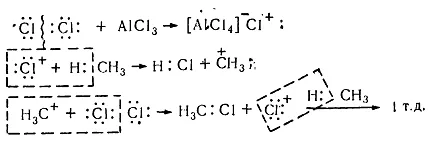
Figura 8. clorurarea metanului