chimice din
catalizator este de mare importanță în realizarea industrială a proceselor catalitice.
5. Când cataliză pozitivă a catalizatorului scade energia de activare a reacției. Acest lucru se datorează faptului că energia de activare pentru formarea complexelor intermediare ale catalizatorului cu reactanții pornind și formarea acestor produși de reacție este de obicei mult mai mică decât energia de activare a reacției necatalitică.
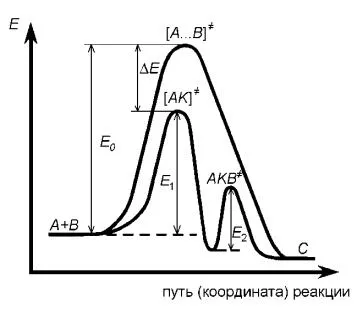
Cifra (8.1) este reprezentat de schimbarea sistemului energetic în reacția bimolecuă catalitică și necatalitic
Figura - 8.1 Variația potențialului energetic într-un reacții catalitice și non-catalitice omogene
În absența catalizatorului, mecanismul poate fi reprezentat prin
Reducerea energiei de activare E A corespunde cu (de obicei
Din ultima ecuație mai jos sunt câteva concluzii importante:
1. Viteza de reacție este proporțională cu concentrația inițială a catalizatorului C 0 K.
2. În general, ordinea reacției va fi fracționată.
3. Dacă C A K pavn. »1, apoi υ = k 3 K 0 C și reacția devine zero reacție, pentru a materiei prime A. Aceasta înseamnă că toate catalizatorul complex este conectat la intermediarul și viteza de reacție este determinată prin numărul său.
4. Dacă C A K pavn. «1, apoi υ = k 3 k p C A C 0 C și reacția este o primă reacție, pentru a materiei prime A; n A = 1.
Astfel, ordinea reacției variază în funcție de concentrațiile de reactiv (material de pornire A). Această caracteristică posedă doar reacție catalitică.
8.4 cataliza heterogena
cataliza eterogena este de o importanță crucială în industriile chimice moderne de unele estimări până la 70% produse chimice obținute prin utilizarea unor procese geterogennokataliticheskih. Deoarece exemplele de sinteză de acid sulfuric bazat pe oxidarea catalitică a oxidului de sulf (IV) SO 2 la oxid de sulf (VI) SO 3 într-un catalizator de platină-vanadiu (Pt, V 2 O 5); sinteza amoniacului din hidrogen și azot, în catalizatorii de fier promovate cu oxizi de potasiu, aluminiu; oxidarea amoniacului în oxizi de azot la catalizatori de platină (acid azotic) și altele.
Pentru că în cataliza eterogenă, catalizatorul constituie o fază separată și procese catalitice care se desfășoară la suprafață (interfața de fază) sa, apoi un rol important în cursul
reacții catalitice heterogene este jucat de procese de transfer de masă. Acestea sunt caracterizate prin toate caracteristicile care au fost luate în considerare în studiul reacțiilor chimice eterogene, de exemplu, proces poate fi limitată de o singură etapă și are loc în difuziunea sau regiunea de tranziție cinetică. În prezent se crede ferm stabilit că acțiunea catalitică prin interacțiune chimică are loc reactanți etapă cu suprafața catalizatorului sau cu porțiunile sale individuale, numite situsurile active. Rolul centrelor active de joacă adesea proeminențe și nervuri pe faza cristalină a suprafeței catalizatorului, defectele de cristal, etc.
In general, procese catalitice eterogene pot fi împărțite în următoarele etape:
1. Difuzarea precursorilor din soluție sau faza gazoasă la suprafața catalizatorului,
2. Adsorbția moleculelor de materii prime de pe centrele active ale catalizatorului, datorită forțelor chimice și electro-statice cu o anumită formă de intermediar:
3. Activarea statului adsorbit (energia necesară pentru acest lucru este adevărat energia de activare):
4. Dezintegrarea activat complex pentru a forma
produși de reacție adsorbite:
5. Desabsorbtia produșilor de reacție de la suprafața catalizatorului.
6. Difuziunea produșii rezultați din reacția suprafeței catalizatorului. Deoarece reacția heterogen catalitică să aibă loc între
adsorbit pe situsurile active ale moleculelor, ecuația ratei de astfel de reacții sunt concentrațiile de suprafață ale reactanților. De exemplu, hidrogenarea etilenei în catalizator de cupru are loc între moleculele de etilenă și hidrogen adsorbiți:
C 2 H 4 (anunțuri.) + H 2 (anunțuri.) = C 2 H 6.
și viteza de reacție este proporțională cu produsul dintre concentrațiile de suprafață:
fapt experimental drept catalizator otrăvesc cantitate extrem de mică de otrăvuri care pot suprima complet activitatea catalizatorului.
O trăsătură specifică a proceselor heterocatalytic este capacitatea catalizatorului de a otrăvirii și promovare.
Promovarea - creșterea activității catalizatorului în prezența unor substanțe care nu sunt ele însele catalizatori pentru acest proces (promotori). De exemplu, pentru nichel reacție catalizată cu metal
CO + H2 -> CH 4 + H 2 O
administrarea unui catalizator de nichel ceriu mici impurități duce la o creștere bruscă a activității catalizatorului.
Intoxicație - scădere bruscă a activității catalizatorului în prezența anumitor substanțe (așa numitele otrăvuri catalitice ..). De exemplu, pentru reacția de sinteză a amoniacului (catalizator - burete de fier) este prezent în amestecul de reacție, oxigen sau sulf compuși determină o scădere dramatică a activității catalizatorului de fier; în același timp, capacitatea adsorbante precursorilor de catalizator scade foarte ușor.
Principalele teorii contemporane ale cataliza heterogenă sunt teoria multiplei și teoria ansamblurilor activi.
Teoria multiplet. Conform acestei teorii site-ul activ este o colecție de mai multe site-uri de adsorbție pe suprafața catalizatorului. Adsorbția moleculelor formate în reacție multiplet complex la situsul activ, prin care comunicarea este redistribuit și produșii de reacție formați. Adsorbția se desfășoară în conformitate cu principiile respectării geometrice și a energiei.
REZUMAT corespondență geometrică este că aranjamentul puterii în centrul multiplei trebuie să corespundă locația atomilor din molecula adsorbit.
Conform principiului de potrivire de putere, compoziția optimă a catalizatorului îndeplinește condiția egalității energiei formării și distrugerii multiplet complexe. interacțiune prea slab și prea puternic reactanților cu catalizatorul este de nedorit.
Pentru a explica aceste caracteristici ale proceselor catalitice heterogene G. Taylor a făcut următoarea Ipoteză: catalitica activă nu este întreaga suprafață a catalizatorului, dar numai unele zone eѐ - așa-numitul centre active. care pot fi diferite defecte ale structurii cristaline a catalizatorului (de exemplu, protuberanțele sau depresiunile de pe suprafața catalizatorului). În prezent, nu există nici o teorie unificată a cataliza eterogene. Teoria multipleți a fost dezvoltat pentru catalizatori metalici. Principalele prevederi ale teoriei multiplei sunt după cum urmează:
1. Un situs catalitic activ este o colecție de un anumit număr de centre de adsorbție situate pe suprafața catalizatorului în conformitate cu structura geometrică a transformării moleculei în curs.
2. Atunci când reacția dintre moleculele de adsorbție formate multiplet complex la situsul activ, având ca rezultat o redistribuire a obligațiunilor rezultând în formarea produșilor de reacție.
Teoria multipleți uneori numită teoria similitudinii geometrice a zonei active și moleculele reactive. Pentru reacții diferite, numărul centrelor de adsorbție (fiecare dintre care este identificat cu atomul de metal) în situsul activ este diferit - 2, 3, 4, etc. Astfel de site-uri active sunt numite, respectiv, dublet, triplet, cvartet, etc. (În general m, și care își datorează numele teoriei).
Teoria ansamblurilor activi. Conform acestei teorii, procesul catalitic are loc la un grup de atomi numit ansamblu activ. Spre deosebire de teoria multiplet, atomii de ansamblu activi nu sunt elemente ale rețelei cristaline și catalizatorul pot migra în mod liber într-o zonă definită a suprafeței catalizatorului. Migrația este limitată de bariere potențiale care apar din cauza fisuri microscopice, prezența impurităților, neuniformitatea suprafeței solide.
8.5 enzimatica Catalysis
Valoarea excepțională în cataliza omogenă ia bază cataliza enzimatică a vieții animalelor și a plantelor. Enzimele sunt compuse în totalitate sau în cea mai mare parte a proteinelor.
Enzyme Catalysis - reacțiile catalitice au loc cu participarea enzimelor - catalizatori biologici ai naturii proteinelor. cataliza enzimatica are două caracteristici:
1. Activitate intensă. câteva ordine de mărime mai mare decât a catalizatorilor anorganici, datorită unei diminuări însemnate de activare energetică a procesului enzimatic. Astfel, constanta de viteză a reacției de descompunere a peroxidului de hidrogen catalizată de ionii de Fe 2+. din 56 s -1; viteză constantă de aceeași reacție catalizată de enzima catalaza, este 3,5 x 10 7 adică
Acolo unde K m - constanta Michaelis. numeric egală cu concentrația substratului la υ = ½ υ max. Constanta Michaelis este o măsură a afinității între substrat și enzimă: mai puțin la m. cu atât mai mare este capacitatea lor de a forma un complex enzimatic substrat.

Figura - 8.5 Dependența vitezei de reacție enzimatică pe concentrația substratului
O trăsătură caracteristică a acțiunii enzimelor este, de asemenea, activitatea enzimei foarte sensibile la condițiile externe -
pH-ul și temperatura. Enzimele sunt activi numai într-un interval destul de îngust de pH si temperatura, enzima caracterizata prin prezenta in acest interval o activitate maximă la un pH optim și temperatură; pe fiecare parte a acestei valori, activitatea enzimei scade rapid.
Pentru a descrie cinetica reacțiilor enzimatice utilizând
ecuația Michaelis Menten (8.20).
Să considerăm ieșirea ecuației cinetice pentru procesul catalitic omogen, de exemplu, reacția cu un material de pornire (substrat) S. P care este transformat în produsul în prezența catalizatorului K (în particular, un astfel de catalizator poate fi o enzimă):
Sensul fizic al acestei ecuații este că, la concentrații mari, toate precursorului catalizatorului inclus în KS compus intermediar. Concentrarea KS ajunge
Valoarea limită C K 0. Ca urmare, rata producției de
produsul atinge valoarea limită pentru o anumită cantitate de catalizator, notată υ max.

Activitatea de laborator №1
Un studiu al vitezei de inversiune de zahăr din trestie
Obiectiv: Pentru a studia rata de inversiune a zahărului din trestie și se calculează inversiunea constantă a vitezei de reacție.
Inversiunea zahărului din trestie este hidroliza acidă catalizate de zaharoză, care sunt obținute ca rezultat al zaharuri simple: glucoză și fructoză. Această reacție este utilizată pe scară largă în producția industrială. Ecuația reacției are forma:
Această reacție este practic ireversibilă, iar mecanismul său, așa cum se vede din ecuație, este bimolecular. În consecință, eѐ viteza poate fi calculată printr-o ecuație cinetică:
Cu toate acestea, reacția are loc într-o soluție apoasă în care concentrația de apă este semnificativ mai mare decât concentrația de zaharoză. Prin urmare, risipa de molecule de apă în reacție poate fi neglijată și considerată concentrație constantă de apă. atunci
și anume reacția bimolecular este descrisă de fapt, prin ecuația cinetică a primei reacții comandă. Astfel de reacții sunt denumite nsevdonervogo ordine reacții, iar constanta de viteză poate fi calculată conform ecuației
Molecule de toate zaharuri, inclusiv zaharoză, glucoză și fructoză conțin atom de carbon asimetric, care are ca rezultat activitatea lor optică și capacitatea de a roti planul de polarizare