Calorimetrul - enciclopedia liberă online - Enciclopedia & Dicționar
Calorimetru (din CALOR latină -.. Căldură și metru)
un dispozitiv pentru măsurarea cantității de căldură eliberată sau absorbită în orice proces biologic fizic, chimic sau. Termenul "K" a fost propusă de Lavoisier și Laplace, P. (1780).
K. Modern funcționează în intervalul de temperatură 0.1-3,500 K și permit să se măsoare cantitatea de căldură până la 10 -2%. K. Aparatul este foarte flexibil și depinde de natura și durata procesului în studiu, regiunea de temperatură în care se efectuează măsurătorile, cantitatea de căldură care sunt măsurate și precizia cerută.
K. conceput pentru a măsura totală Q. cantitatea de căldură eliberată în timpul acesta de la început până la sfârșit se numește K. integrator; K. măsurarea puterii termice L și a modificărilor în diferite etape - un contor de energie sau K-osciloscop. Prin construcție, sistemul de măsurare și metoda calorimetrului distinge între K. lichidă și masiv single și dublu (diferențial).
integrator lichid K. cu temperatură variabilă (Fig. 1) pentru shell izotermic utilizat pentru măsurarea căldurii de dizolvare și căldura reacțiilor chimice. Se compune dintr-un recipient cu un lichid (de obicei apa), care sunt: camera pentru desfășurarea procesului de testare ( „bomba calorimetrului“), agitator, încălzire independentă și termometru. Căldura eliberată în camera, apoi distribuit între camera și celălalt fluid. Părți K., care împreună sunt numite sistem de instrumente calorimetru. Schimbarea în stare (de exemplu, temperatura) sistem calorimetric măsoară cantitatea de căldură introdusă în K. Sistemul de încălzire este termometru calorimetru fix. Înaintea măsurătorilor este calibrat K. - determină variația temperaturii sistemului calorimetrului prin conferirea o anumită cantitate de căldură (încălzitor K. sau ca rezultat al camerei de reacție chimică cu o cantitate cunoscută de substanță etalon). Ca rezultat, valoarea de calibrare K cuprinde obținerea unui m termic. E. Un coeficient care trebuie multiplicat pe măsurate schimbarea temperaturii K. termometru pentru a determina cantitatea de căldură pus în ea. Valoarea termică a K este sistemul calorimetric capacitatea calorică (c). . Determinarea căldurii necunoscute de combustie sau reacție chimică etc. Q reduce la un sistem de măsurare calorimetrică schimbare a temperaturii cauzate At de proces investigat: Q = c .Δt. În mod tipic valoarea Q referire la greutatea substanței conținute în camera K.
măsurare calorimetrică permit să se determine în mod direct numai cantitatea de căldură a procesului de testare și diferite procese secundare, cum ar fi agitarea, evaporarea apei, cu spargerea fiolei de substanțe etc. procesele laterale de căldură trebuie să fie determinată prin experiment sau calcul și excluse din rezultatul final. Unul dintre procesele este parte inevitabil de transfer de căldură K. cu mediul prin radiație și conducție. În procesele secundare de contabilitate ordine în principal sistem de schimb de căldură coajă de surround calorimetrică a cărui temperatură este controlată.
Într-un lichid izoterm K. Temperatura cochilie este menținută constantă. La determinarea reacției chimice încălzește cele mai mari dificultăți adesea asociate fără a lua în considerare procesele secundare și definirea completitudinea reacției și la necesitatea de a lua în considerare mai multe reacții.
VK-integrator o altă specie - izoterma (temperatură constantă) introdusă deasupra căldurii nu schimbă temperatura sistemului calorimetric, și determină o schimbare în starea de agregare a corpului, care formează o parte a sistemului (de exemplu, topirea gheții în gheață Bunsen calorimetrului). Numărul de căldură introdusă este calculată în acest caz, în greutate, o substanță care schimbă starea de agregare (de exemplu, greutatea de gheață topită, care poate fi măsurată printr-o schimbare de amestec volum de gheață și apă) și căldura de tranziție de fază (vezi. Căldura de tranziție de fază).
integrator K. masiv este cel mai des utilizat pentru a determina entalpia (A se vedea. Entalpia) din materiale la temperaturi ridicate (2500 ° C). Sistemul calorimetru K. de acest tip este un bloc metalic (de obicei din cupru sau aluminiu) cu degajări pentru vasul în care are loc reacția, termometru și încălzire. Entalpia substanței este calculată ca produsul dintre K valoarea căldurii prin diferența de temperatură bloc ascensiuni măsurată după cădere în soclu cu o anumită cantitate de substanță fiole, apoi fiola goală, încălzit la aceeași temperatură.
Gazele de capacitate de căldură, și uneori lichide, determinate în m. N. K. curgere labirint - prin diferența de temperatură la intrarea și ieșirea fluxului de fluid sau flux de gaz staționare, și puterea căldurii Joule, un încălzitor electric dedicat K.
K. acționează ca un contor de energie, față de K-integrator trebuie să aibă un transfer semnificativ de căldură pentru a introduce cantitatea de căldură se îndepărtează rapid și starea K determinată de valoarea instantanee a puterii procesului termic. Alimentarea cu energie termică este procesul de schimb de căldură cu coajă K. O astfel de K. (Fig. 2), dezvoltat de fizicianul francez E. făta (Ye Calvet, 1895-1966), este un bloc de metal cu canale, care sunt plasate în celulă cilindrică. In celula, procesul în studiu este realizat; bloc de metal joacă rolul învelișului (temperatura este menținută constantă, cu o precizie de 10 -5 -10 -6 K). Diferența de temperatură măsurată de către unitatea de celule și termopil având 1000 intersecții. Căldură emf de celule de schimb și termopil mici este proporțională cu diferența de temperatură care apar între unitate și celulă, atunci când căldura eliberată sau absorbită. Blocul este plasat în principal două celule care funcționează ca termofilă diferențială K. fiecare celulă au același număr de intersecții și, prin urmare, diferența lor permite electromotoare determina direct diferența dintre fluxurile de capacitate de căldură care intră în celulă. Această metodă evită măsurătorile de distorsiune măsurate fluctuații aleatorii bloc de temperatură. Fiecare celulă montat de obicei două termopil: permite să compenseze puterea termică a procesului de testare bazat pe efectul Peltier, iar celălalt (indicator) este utilizat pentru a măsura o parte necompensată a fluxului de căldură. În acest caz, dispozitivul funcționează ca o compensare diferențială K. La temperatura camerei, o astfel de capacitate termică K. măsurată procese de până la 1 mW.
Numele convențional K. - „reacție chimică“, „bomba“, „izotermă“, „de gheață“, „de joasă temperatură“ - sunt de origine istorică și punct principal pe metoda și domeniul de utilizare K. nu sunt nici complete, nici caracteristica lor comparativă .
Clasificarea generală K. pot fi construite pe baza examinării trei variabile principale care determină metoda de măsurare: temperatura calorimetrică Tc a sistemului; Pentru temperatura shell. Sistemul calorimetric de mediu L. cantitatea de căldură eliberată în K. per unitate de timp (o capacitate de căldură).
C. cu constanta izoterma Tc și a apela; cu Tc = To - adiabatic; C. care funcționează la o diferență de temperatură constantă Tc - To. numita K cu transfer de căldură constantă; în isoperibolic K. (aceasta se numește K. shell izoterma) este constantă To. și Tc este funcția capacității calorice L.
Un factor important care afectează rezultatul final al măsurătorilor este de lucru sigură de reglare automată a temperaturii izoterme sau proiectilelor adiabatic. La temperatura adiabatic shell K. este reglată astfel încât să fie mereu aproape de temperatura de schimbare a unui sistem calorimetru. shell adiabatic - ecran metalic ușor, prevăzut cu un sistem de încălzire - reduce transferul de căldură, astfel încât temperatură K. variază de la numai câteva zeci de miimi de grade / min. de multe ori se reduce transferul de căldură în timpul experimentului calorimetrică la o valoare nesemnificativă, care pot fi neglijate. Dacă este necesar, rezultatele măsurărilor directe sunt corectate pentru schimbul de căldură, metoda de calcul care se bazează pe legea lui Newton de transfer termic - proporționalitatea debitului de căldură între K și diferența manta de temperaturile lor, în cazul în care diferența este mică (până la 3-4 ° C).
K. Pentru cădură izoterma reacției chimice poate fi determinată cu o precizie de până la 0,01%. Dacă dimensiunile mici K., temperatura variază mai mult de 2-3 ° C, iar procesul de monitorizare este lung, atunci corecția plic izotermice pentru schimbul de căldură poate ajunge la 15-20% din valoarea măsurată și limita drastic precizia măsurătorilor. În aceste cazuri, este mai indicat să se utilizeze un shell adiabatic.
Cu adiabatic K. determina căldura specifică a substanțelor solide și lichide în intervalul 0.1 - 1000 K. La temperatura camerei și inferioară adiabată K. protejat manta de vid este scufundat în vasul Dewar (A se vedea. Dewar), umplut cu heliu lichid, hidrogen sau azot (fig. 3). La temperaturi ridicate (peste 100 ° C) a fost plasată într-un cuptor electric cu termostat K..
Lit:. Popov M. M. Termometrie și Calorimetria, 2nd ed. Moscova, 1954; Skuratov SM KOLOSOV VP Vorobev A. F. termochimic, 1-2 ore, M. 1964-1966 .; Calvet E. Prat A. Micro-calorimetrie trans. cu Franța. M. 1963; termochimic Experimental, v. 1-2 N. Y. - L. 1956-1962.
Fig. integrator 1. Liquid calorimetru cu coajă izoterma (schema): 1 - "bombă calorimeter"; 2 - încălzitor pentru excitarea reacției; 3 - calorimeter de fapt (vas umplut cu apă); 4 - termometru cu rezistență; 5 - un frigider (tubul prin care aerul rece poate fi trecut); 6 - shell calorimetru izoterm umplut cu apă; 7 - încălzitor teacă; 8 - termometru de contact pentru carcasa de reglare a temperaturii; 9 - termometru de control; 10 - cu un agitator mecanic.
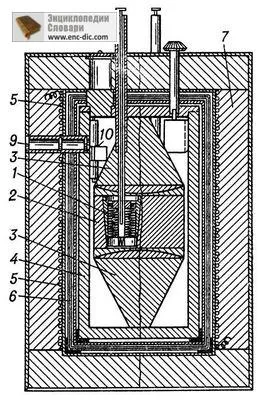
Fig. 2. E. Calvet Calorimetru pentru măsurarea proceselor de putere termică (Schema) 1 - celula calorimetric cu termocupluri; 2 - bloc calorimetru; 3 - conuri de metal pentru a crea un câmp uniform de temperatură în bloc; 4 - coajă; 5 - încălzitor pentru dispozitivul de control al temperaturii; 6 - scuturi termice; 7 - izolație termică; 8 - tubul pentru introducerea unei substanțe în calorimetrului; 9 - fereastra pentru eșantionarea galvanometru 10.
Fig. 3. adiabatică Calorimetru pentru determinarea capacității de căldură la temperaturi scăzute (Schema) 1 - calorimetru (a - un vas pentru substanță, - un termometru cu rezistență, în - încălzitor); 2 - coajă adiabatică (ecran); 3 - jachetă de vid; 4 - o conductă de pompare; 5 - tub pentru cabluri electrice.
Marii Enciclopedii Sovietice. - M. sovietic Enciclopedia 1969-1978