acizi și baze tari și moi
Noțiunile de acizi și baze tari și moi, RJ Pearson
utilizat în prezent conceptul invocat de Pearson, că toți acizii și bazele pot fi împărțite în două clase - moi și dure. Pentru ei, regula adevărat: acizi moi se leaga cu baze moi, acid tare - o bază rigidă.
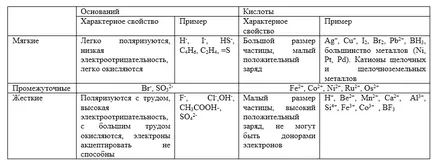
Acizii moi sunt responsabile mari și mici pozitive ($ Cu ^ + $, $ Ag ^ + $, $ Au ^ + $, $ Hg ^ + $, $ Pt ^ $, $ Br_2 $, $ I_2 $ et al.) .
Acid Hard caracterizat prin dimensiuni mici și o sarcină pozitivă mare ($ H ^ + $, $ Mn ^ $, $ Fe ^ $, $ CO ^ $ et al.). Ele pot acționa doar ca acceptori de electroni.
Baze moi sunt agenți puternici de reducere ($ H ^ - $, $ I ^ -. $, $ S ^ $, $ CO $, $ R_2S $ et al).
Bazele rigide sunt oxidanți puternici ($ F ^ - $, $ Cl ^ - $, $ OH ^ - $, $ NH_3 $, $ H_2O $ et al.).
Pentru acizii intermediari sunt $ dublu d $ - ionii ($ Fe ^ $, $ CO ^ $, $ Ni ^ $ et al.) Și baze intermediare ($ Br ^ -. $, $ SO_3 ^ $ et al).
Proprietățile distinctive ale acizilor tari și moi si baze
Conceptul de greu și moale, nu sunt concepte identice de puternice și slabe.
Și exemple de cele mai importante caracteristici ale acizilor tari și moi si baze sunt listate în tabelul
Din punctul de vedere al acizilor tari și moi teorii ia în considerare următoarele reacții:
Reacțiile asociate cu transferul de electroni
$ H_3O ^ + + NH_3> H_2O + NH ^ $
O reacție de adiție pentru a forma compuși (reacția dintre acidul și baza într-o formă generală .:
substituție nucleofilă. Particule - nucleofil (anion sau moleculă) $ B: `$ poartă o singură pereche de electroni, din cauza căreia o nouă legătură. $ AB $ molecula suferă atac nucleofil, $: B $ este o grupare labilă.
substituție electrofilă. agent electrofilic A, este coji de electroni incomplet și tinde să le umple. Molecule $ BA $ se confruntă cu un atac al electrofil.
Comunicare acizi dure cu o bază rigidă se datorează puterii ionice. bază moale se leagă de acid moale prin legături covalente. Pentru o legătură covalentă a fost suficient de puternic, este necesar ca atomii au fost similare în valori de mărime și electronegativitate.
Acesta este utilizat pe scară largă în scopuri practice:
Aceasta explică de ce în natură apare ca oxid de aluminiu, hidroxid și silicat, cupru, mercur - ca sulfurile, calciu - ca carbonat. Metale elementelor grup de tranziție VIII acizi moi catalizează reacții care implică bază slabă (monoxid de carbon). bază Softer (compusul de arsenic și fosfor) sunt otrăvuri catalitice, deoarece acestea pot forma compuși stabili cu aceste metale și blochează centrele lor active.
Aceasta explică toxicitatea monoxidului de carbon la om. Dioxidul de carbon formează un compus mai stabil decât hemoglobina oxigen cu fier feros.
In mod similar, monoxidul de carbon sunt ionii metalelor grele ($ Pb ^, Hg ^ $), care interacționează cu $ SH $ - grupuri fiziologic importante ale compușilor pot dezactiva funcția lor.