13 alcaline de metale pământoase, beriliu, magneziu, de oxizi, hidroxizi și săruri
Metale alcalino-pământoase, beriliu, magneziu: oxizii lor, hidroxizi și săruri. Noțiunea unui compus organomagneziu
13.1. Caracteristicile generale ale principalelor metale subgrupe din grupa a II-
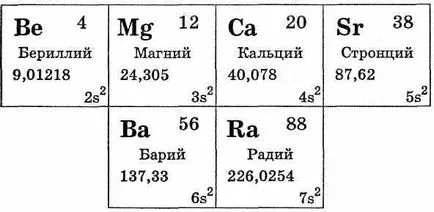
Subgrupa principal al grupei II includ beriliu Be, Mg magneziu, calciu Ca, Sr stronțiu, bariu Ba, radiu Ra. Dintre aceste Kal, strontiu țiilor, bariu aparțin familiei de metale alcalino-pământoase (vezi. Tabelul. 29).
Acest lucru s-elemente. Într-o substanță de metal tipic simple. Pe plan extern sunt doi electroni. Oferindu-le, ele prezintă un grad de oxidare a compușilor 2. In reacții redox toate metalele subgrupă se comportă ca agenți reducători puternici, dar ceva mai slabe decât metalele alcaline. Acest lucru se datorează faptului că atomii de metal din grupa II au o rază atomică mai mici decât atomii de metal Corespunzător vuyuschih-alcaline, situate în aceleași perioade. Acest lucru se datorează unor compresia cojile de electroni, așa cum s-subnivel al stratului exterior de electroni au fost finalizate, astfel încât electronii th-le mai aderente.
Proprietățile fizice și chimice ale elementelor din grupa principală grupa II
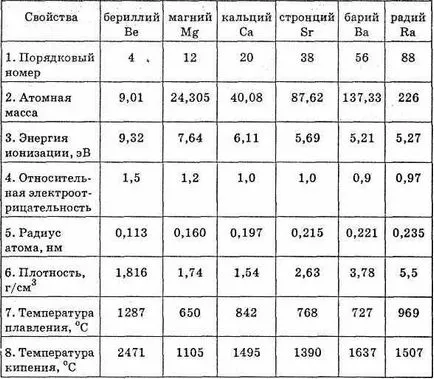
Cu numărul ordinal crescând al electronilor de recul-facilitată de, și, prin urmare, proprietățile metalice ale natural OMS-topitură. Mai viu apar în alcalină UI-taliu.
Trebuie remarcat faptul că în proprietățile lor, beriliu și magneziu sunt oarecum diferite de metale alcalino-pământoase de calciu, stronțiu și bariu (radiu Group ultim element se deosebește de celelalte metale alcalino-pământoase proprietăți naturale radioak tive).
Calciu, stronțiu și bariu sunt oxidat în aer la o compoziție de oxizi RO, totuși acestea sunt stocate fără accesul aerului sau a navelor germil matically închise, sau sub un strat de eter sau petrol lampant. Beriliu și magneziu la temperatura camerei, în kryvayutsya aer pentru peliculă subțire de oxid, care le protejează de oxidare în continuare. Pentru acești oxizi metalici este necesar pentru a le arde:
Calciu, stronțiu și bariu se descompun apa chiar la temperatura obișnuită, pentru a forma hidroxidul corespunzător și hidrogen divid tine:
Hidroxizi ai metalelor alcalino-pământ ușor solubile în apă, lor crește solubilitatea la Ca (OH) 2 la Ba (OH) 2.
apa Beriliu nu interacționează, deoarece format la primul punct de hidroxid greu solubil al filmului beriliu Be (OH) 2 metal oferă protecție. hidroxid beriliul Be (OH) 2 are un caracter amfoter:
Cu toate acestea, proprietățile Be (OH) 2 ca bază exprimat mult mai clar acid.
Magneziul reacționează cu apa numai atunci când este încălzit:
Hidroxid de magneziu - o bază tipică.
Atunci când este încălzit, toate metalele principale grupa grupa II reacționează cu hidrogen activ (dând hidruri RH2. Mi cu halogen, sulf, azot, fosfor, carbon.
Din acest subgrup metalele cele mai importante sunt magneziu și calciu.
^ 13.2. Magneziu și compușii săi. organomagnezieni
Magneziu - un metal alb-argintiu foarte deschis. Densitatea sa este de 1.739 g / cm3 - 1/3 mai mică decât densitatea aluminiului. La puterea magneziului de aluminiu este mai mare de aproximativ 2 ori. aliaje pe bază de magneziu ocupă unul dintre primele locuri în structura companiei aeriene.
Magneziul este destul de rezistent la oxidare, deoarece aer în folie protectoare kryvaetsya. Magneziul este un puternic Soare-stanovitelem. Dacă panglica de magneziu pentru a aprinde, repede CDF-raet cu un flash orbitoare, în curs de dezvoltare de căldură. Magneziul este utilizat în fotografierea cu bliț, în fabricarea de rachete de semnalizare, atunci când sunt aprinse amestecuri termite, etc.
Când combustia magneziu dezvoltă o astfel de temperatură ridicată, care poate arde chiar la oxid de carbon (IV), extinderea acesteia: 2mg CO2 = 2MgO C
Oxid de magneziu MgO - substanța refractară alb, bine solubil în acizi. De asemenea, este numit magnezie, care este utilizat la fabricarea cărămizilor refractare, ca punctul său de topire este de 2800 ° C Magneziul este, de asemenea, utilizat în practica medicală.
În aerul de combustie, împreună cu nitrură de oxid de magneziu se formează:
magneziu metalic este mai activ decât prin urmare, hidrogenul poate reacționa cu apa, deplasând hidrogenul din acesta. Reacția se desfășoară la încălzire:
Hidroxidul de magneziu este o bază tipic, foarte puțin solubil în apă.
Cu acizi magneziu reacționează hidrogen foarte deplasând rapid;
Printre sărurile de interes particular este clorură de magneziu MgCl2. care servește ca materie primă pentru prepararea magneziului prin electroliza. În natură, clorura de magneziu se găsește în compoziția E HEPA carnalitului KCl • MgCl2 • 6N2 O și extras din ea.
carbonat de magneziu, magneziu sau alb, apare în natură ca MgCO3 magnezită mineral. precum și o parte din roci Neko-toryh, cum ar fi dolomita CaCO3 MgCO3 •. Dintre ele obținute prin calcinarea magnezie pură:
În apele naturale de magneziu apare hidrogencarbonat Mg (HCO3) 2. oferind rigiditate a apei.
silicați de magneziu - talc interesante 3MgO • 4SiO2 • H2O și azbest 3MgO • 2SiO2 • 2H2O, având retardancy foc mare. Azbestul este o structură fibroasă, astfel încât să poată fi filate și din hainele sale pentru cei care, la temperaturi înalte-. silicați de magneziu, carbonați și insolubile în apă. De asemenea, trebuie remarcat faptul că una dintre cele mai remarcabile ve societăți în natură - verde plantele pigment clorofilă - cu aproximativ 2,7-holding% magneziu. Cu ajutorul clorofilei face ca una dintre cele mai importante procese naturale - fotosintezei. Fără magician-TION nu clorofilă, dar fără viață clorofilă pe Pământ.
^ Conceptul de compus organomagneziu
Compușii organomagnezici conțin legătură Mg-C; cu formula generală R2 Mg și RmgX (în care R - un radical organic, X - de preferință CI, Br, I). Cel mai important RmgX (REACT-you Grignard) - solide, care datorită reactivității lor SEASON Coy este obținut și utilizat ca-se întâmplă pe cursele aeriene, cel puțin - în alți solvenți organici.
Metilmagneziu iodura CH3 Mgl, metilmagneziu CH3 MgCI, phenylmagnesium C6 H5 MgCl - compus organomagnezian bazic. Acestea sunt utilizate în sinteza organică (reacție Grignard), și pentru a determina hidrogen activ pe meto-do Tserevitinova.
^ 13.3. Calciul și compușii săi. duritatea apei
Fiind în natură
In industrie, calciu produs prin electroliza unui amestec de săruri topite: CaCl2 (75-85%) și KC1 la 700 ° C
Calciu - un metal alb-argintiu, destul de solid, pune-tac. calciu natural este un amestec de șase izotopi cu numere de masă sovymi-40 (izotop majore), 42, 43, 44, 46 și 48. Studiile au folosit un izotop artificial Ca 45 20.
Calciul este ușor de oxidat în aer, deci este ca potasiu și sodiu, stocat sub stratul de kerosen.
Când oxidarea calciului în aer este format din oxid de calciu, sau, după cum se știe, nestins (nestins) var CaO:
calciu preincalzit arde in oxigen, dar nu la fel de strălucitoare ca magneziu. Calciul reacționează energic cu apă fierbinte, deplasând hidrogen din aceasta și formează hidroxid de calciu, sau Ca varul stins (OH) 2:
În condiții normale, calciul reacționează cu halogen și sulf, azot și carbon sub încălzire:
Calciu, magneziu, cum ar fi exponate pronunțate proprietăți Sun-stanovitelnye.
Oxid de calciu CaO ca oxid de magneziu, are o temperatură foarte ridicată de topire - aproximativ 3000 ° C
In industrie, oxid de calciu obținut prin arderea calcarelor de cretă sau alte roci carbonatice:
Dacă CaO se toarnă apă, este o reacție foarte violentă, însoțită-făcându-se permanent șuierat, o evoluție puternică de căldură și de creștere a volumului. Formele hidratate ale mesajului în acest proces - Ca (OH) 2:
Un amestec de var hidratat, nisip si apa se numește NYM constructor sau mortar. Este folosit ca shtu-katurki și pentru cărămizi lipirea la pereți de zidărie, cu toate că în acest din urmă caz, utilizate în mod obișnuit de ciment.
Solidificarea se produce într-un mojar, rezultatele sunt flux simultane a două procese:
1) precipitarea dintr-o soluție suprasaturata de cristale de hidroxid de calciu, care se leaga ferm particulele de nisip împreună;
2) formarea de carbonat de calciu prin reacția:
var stins - un solid alb, solubil în apă-ma, dar solubilitatea sa este scăzută. O soluție de var stins în apă se numește apă de var. Are proprietăți alcaline-. La trecerea prin soluția de var apă CO2 devine tulbure și dispare mai departe cu turbiditate pasaj:
apa de var este utilizat ca reactiv pentru oxid de carbon (IV), precum și pentru a îndepărta temporar duritatea apei vyzy-Du- carbonat de calciu Ca (HCO3) 2.
Volatile compus colorant de calciu în flacăra arzătorului cărămizie culoare.
După cum se știe, în natura apei pure nu este practic întâlnirea etsya - în structura sa conține întotdeauna ioni de diferite săruri. Apa, în care compoziția conține o mulțime de Ca Mg 2. 2. 2. Sr Fe. numit, duritatea apei strânse și cauzează Xia, în principal Ca 2 și Mg 2. ioni în apă dură, săpun mylitsya rău rău fierte legumele moi, iar în timpul utilizării lor, cum apa SRI cazane de abur format scară, ceea ce poate duce la o explozie a cazanului. Apa dură înainte de a mânca-niem trebuie să se înmoaie. Distinge carbonat și ajustat la duritatea apei camerei-nekarbo.
Carbonat numit duritatea apei datorită Xia care conține în ea bicarbonați de calciu și magneziu. Când fierberea distrus sărurile pentru a forma carbon-ing slab solubili, iar ionii de Ca și Mg 2 2 îndepărtat din soluție:
Prin urmare, duritatea carbonaților este adesea numit duritatea temporară a apei.
rigiditate Noncarbonate este determinată în prezența apei și a sulfaților de cloruri de calciu și magneziu, nu sunt transferate pentru a precipita la reflux simplu și de aceea se numește duritatea apei constantă. Pentru a elimina calciul și magneziul este precipitat prin soda:
In ultimii ani, pentru a elimina duritatea apei de ioni schimbătoarele sunt utilizate pe scară largă.